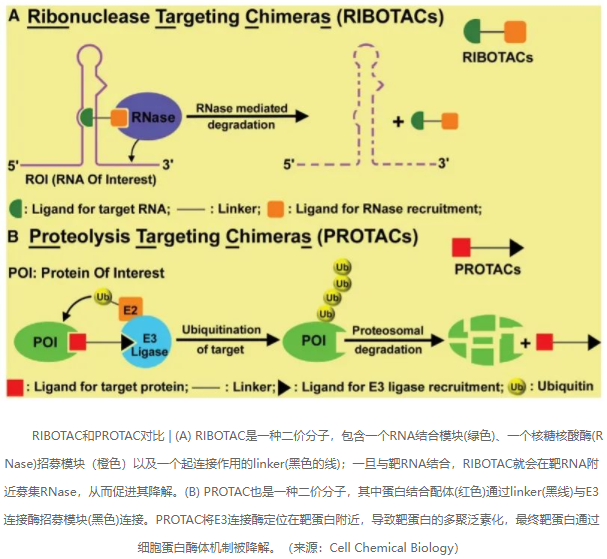
RIBOTAC:开启RNA降解新时代
PROTAC全称为Proteolysis-Targeting Chimeras,即蛋白水解靶向嵌合体,是一种不同于抗体和传统小分子抑制剂的新兴药物类型。经过近几年的快速发展,PROTAC领域进展显著,目前已有多个项目进入临床开发阶段,为解决传统小分子的耐药性、靶向不可成药靶蛋白带来了前所未有的机会。
与靶向降解蛋白质的PROTAC技术类似,靶向降解RNA的RIBOTAC技术也在兴起。RIBOTAC全称为Ribonuclease-Targeting Chimeras ,即核糖核酸酶靶向嵌合体,其功能是将靶RNA“带给”RNA酶以实现降解。
10月27日,最新发表在Science Translational Medicine杂志上的一项研究中,RIBOTAC技术先驱、Scripps研究所的Matthew Disney教授带领团队设计了一种能够降解肌萎缩性侧索硬化症(ALS)和额颞叶痴呆(FTD)中的致病RNA的RIBOTAC分子[1]。在患者来源的脊髓神经元和ALS小鼠模型中,RIBOTAC分子均成功诱导致病性mRNA的降解并减少了相关的病理学。
Disney教授在过去15年里一直致力于研究RNA分子可成药的结构,并建立了能够结合这些可成药结构的化合物库。RIBOTAC的成功开发,正是建立在这些基础上。
RIBOTAC最早引发关注是在2019年,当时Disney教授在Cell Chemical Biology杂志上发表了一篇关键成果,描述了他们开发的一款具有抗癌潜能、介导选择性RNA降解的RIBOTAC分子[2]。
RIBOTAC的开发基于能够选择性结合RNA(尤其是能够形成复杂二级和三级结构的RNA)的小分子,关键的创新在于通过连接核糖核酸酶(RNase)招募分子将RNA结合分子,转变成了RNA降解分子。
具体来说,这篇Cell Chemical Biology论文描述了可介导pre-miR-210选择性降解的RIBOTAC分子TGP-210-RL。TGP-210-RL源自TGP-210,后者是Disney教授团队先前开发的一种能结合pre-miR-210的小分子。TGP-210与tetra-adenylate连接,形成TGP-210-RL。Tetra-adenylate类似于病毒感染时细胞内产生的内源性寡腺苷酸(oligoadenylates)。Oligoadenylate会激活潜伏的RNase L,使其二聚化并形成活性核糖核酸酶。
Pre-miR-210是一个有吸引力的治疗靶点,因为它是microRNA miR-210的前体,而microRNA miR-210在低氧环境下对癌症生存至关重要。在这项研究中,Disney教授及其合作者证实,TGP-210-RL可诱导TGP-210-R+microRNA前体+RNase L三元复合物的形成。在缺氧的癌细胞中,TGP-210-RL诱导了miR-210水平的显著降低以及细胞凋亡,证明了RIBOTAC靶向降解癌细胞中RNA靶点的潜力。
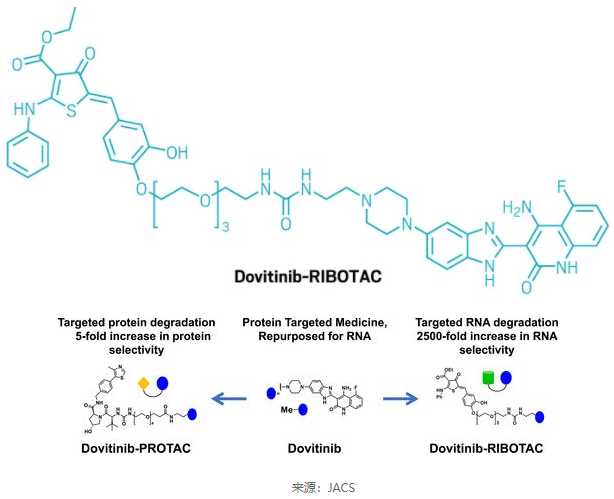
RIBOTAC的第二篇重要论文于今年8月发表在Journal of the American Chemical Society(JACS)杂志上[3]。在这项研究中,科学家们将一款RTK抑制剂dovitinib改造成了靶向降解RNA的小分子RIBOTAC。研究证实,靶向降解pre-miR-21(microRNA-21的前体)的RIBOTAC在三阴性乳腺癌和Alport综合征(遗传性肾炎)小鼠模型中均缓解了疾病进展。基于dovitinib改造而成的RIBOTAC分子对pre-miR-21的选择性增加了2500倍。
而在最新发表于Science Translational Medicine杂志上的这项研究中,Disney教授团队将目光聚焦到了神经退行性疾病ALS和FTD上。
ALS和FTD都是进行性神经退行性疾病,可导致运动和认知障碍。这些疾病通常是散发的,最常见的相关突变是9号染色体开放阅读框72 (C9orf72)中内含子(通常是内含子1)的六核苷酸重复扩增(HRE;GGGGCC重复扩增,引起疾病的重复次数从60次到数千次不等),疾病的这一亚型被称为c9ALS/FTD。
含有HRE的RNA会被翻译成一种包含不同二肽重复结构(通常是poly(GP)或poly(GA))的蛋白质。poly(GP)为聚甘氨酸-脯氨酸,poly(GA)为聚甘氨酸-丙氨酸。含HRE的RNA以及由其翻译而来的含二肽重复结构的蛋白都被认为会促进神经元死亡。这类RNA和蛋白质都会形成有毒的聚集物,RNA还会阻断基因表达机制。
基于这些前期发现,科学家们认为,如果能清除含HRE的RNA,或许能为治疗疾病带来新机会。相比靶向蛋白质,靶向这类致病RNA具有“一石二鸟”的作用。
含HRE的RNA还有另一个值得靶向的特性:这类RNA会形成一种特殊的3D结构,靶向这一特殊的3D结构(而不是初级序列)可能会减少靶向其它含有较短HRE的非致病性mRNA产生的脱靶效应。
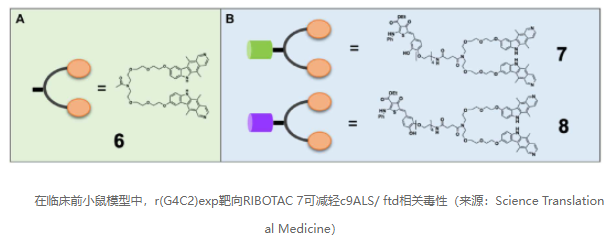
利用结构-活性关系结合生物物理和结构分析,Disney教授及其同事首先设计了一个能够结合上述特殊3D RNA结构的小分子二聚体化合物。每个单体都结合在RNA发夹的内部环内。二聚体结合Kd为4±0.7 nM,在靶RNA上停留时间较长。

接着,Disney教授团队在二聚体的基础上,添加了核糖核酸酶(RNase L)L招募模块,将小分子二聚体变成了一款RIBOTAC分子。在HEK293T细胞中,他们的RIBOTAC分子抑制了翻译,并以一种需要RNase L的方式剂量依赖性地降低了含HRE的RNA水平。此外,RIBOTAC分子也缓解了c9ALS/FTD患者来源的细胞系的病理特征,降低了患者来源的淋巴母细胞细胞系和iPSCs中C9orf72内含子1的丰度,以及iPSCs中二肽重复蛋白的水平。iPSC来源的脊髓神经元(iPSNs,可再现c9ALS/FTD患者脑组织的许多遗传、转录和生化特征)中也可以看到同样的降低。研究未观察到所设计的RIBOTAC分子对其它转录本的影响。
由于先前已有大量研究指出,在c9ALS/FTD患者中,核孔蛋白会减少,因此,该研究还调查了RIBOTAC处理对核孔蛋白水平的影响。通过超分辨显微镜,Disney教授等发现,RIBOTAC恢复了关键核孔蛋白Nup98的水平。
在c9ALS/FTD小鼠模型中,单次侧脑室注射RIBOTAC大大降低了含r(G4C2) 的mRNA、含r(G4C2) 的foci以及含poly(GP)的蛋白质的水平。这些效应在注射后1周就能观察到,并持续到治疗后至少6周(即整个研究期间)。通过免疫组化分析,RIBOTAC也降低了c9ALS/FTD的已知特征,包括poly(GP)和poly(GA)聚集物,以及胞质内含物TDP-43。
科学家们认为,尽管将RIBOTAC推向临床还需要进一步优化其药化和理化性质(这一过程可能需要几年时间),但这项新成果提供了又一项关键证据,表明靶向降解RNA是可行的,且可能会成为治疗RNA发挥关键致病作用的疾病的最佳方式。
临床转化方面,早在2016年,Disney教授就作为科学创始人创办了生物技术公司Expansion Therapeutics,致力于开发治疗RNA介导疾病的小分子药物。今年9月,Expansion刚刚完成8000万美元B轮融资,巨头诺华、赛诺菲继续给与其支持。Expansion目前聚焦神经退行性疾病,包括前文提到的c9ALS/FTD。
小结
包括mRNA、miRNA、长链非编码RNA在内的多种RNA均与疾病相关,因此是潜在的药物靶点。RIBOTAC作为一种新型分子,具有靶向不同类型RNA的潜能,可能比已被开发用于降解RNA的反义寡核苷酸(ASO)和siRNA有一定的优势,包括:1)更好的药代动力学特性,作为小分子,RIBOTAC可能进入更广泛的组织,而ASO和siRNA存在细胞摄取差、组织特异性递送(除了肝脏和肾脏)差、内体逃逸差等问题;2)更低的剂量:RIBOTAC的催化特性是其另一主要优势,在RIBOTAC结合并诱导一个RNA降解后,它可以结合另一个RNA。这样,低浓度的RIBOTAC就可以用来实现目标RNA的降解。
不过,RIBOTAC也面临着难开发的挑战,其中最困难的部分是开发选择性结合细胞中目标RNA的小分子,相比反义寡核苷酸,开发合适的RNA结合配体要困难很多,因为前者可以简单地被编程出来,利用互补序列就可与靶RNA结合。此外,RIBOTAC也面临着早期PROTAC所面临的挑战,即因分子量大而导致细胞吸收差、生物利用度低(TGP-210-RL分子量为> 2000,与TGP-210相比,细胞摄取减低了50%)。RIBOTAC的进一步迭代可能涉及寻找更小的RNase结合配体,值得关注的是,已有文献报道RNase L的小分子激活剂。
注:原文有删减
参考资料:
[1]JESSICA A. BUSH et al. Ribonuclease recruitment using a small molecule reduced c9ALS/FTD r(G4C2) repeat expansionin vitro and in vivo ALS models. SCIENCE TRANSLATIONAL MEDICINE(2021).
[2] Matthew G. Costales et al. Targeted Degradation of a Hypoxia-Associated Non-coding RNA Enhances the Selectivity of a Small Molecule Interacting with RNA. Cell Chemical Biology(2019).
[3]Peiyuan Zhang et al. Reprogramming of Protein-Targeted Small-Molecule Medicines to RNA by Ribonuclease Recruitment.JACS(2021).
[4] Degrading disease-causing RNA in ALS(来源:Nature Reviews Drug Discovery)
[5] Potential treatment for ALS,frontotemporal dementia targets RNA(来源:Scripps研究所)
[6] RIBOTACs: Small Molecules Target RNAfor Degradation(来源:Cell Chemical Biology)
[7] Small-molecule selectively destroys cancer-associated RNA(来源:C&EN)
[8] Neuron | 孙疏影团队揭示RNA解螺旋酶DDX3X调节C9ORF72翻译的机制(来源:BioArt)
[9] Expansion Therapeutics Raises $80 Million Series B Financing to Treat Neurodegenerative Diseases(来源:Expansion)








