JCO:这个癌症患者群体,一线治疗不应考虑免疫疗法
免疫检查点抑制剂(ICIs)作为当前免疫疗法的主力之一,在多种肿瘤的治疗中都似乎都有着亮眼的表现。不久前美国FDA已批准纳武利尤单抗及帕博利珠单抗作为进展期胃食管腺癌(GEAC)的一线治疗,而帕博利珠单抗用于人类表皮生长因子受体2(HER2)阳性胃癌患者的治疗也得到了快速批准。然而,由于肿瘤免疫微环境的高度异质性,免疫治疗对肿瘤的总体
免疫检查点抑制剂(ICIs)作为当前免疫疗法的主力之一,在多种肿瘤的治疗中都似乎都有着亮眼的表现。不久前美国FDA已批准纳武利尤单抗及帕博利珠单抗作为进展期胃食管腺癌(GEAC)的一线治疗,而帕博利珠单抗用于人类表皮生长因子受体2(HER2)阳性胃癌患者的治疗也得到了快速批准。
然而,由于肿瘤免疫微环境的高度异质性,免疫治疗对肿瘤的总体有效率仍不够理想,而免疫治疗与其他治疗方案的联合也并非都能达到协同性的效果。事实上,当前有关ICIs联合多种治疗手段的研究层出不穷,人们似乎更为关注免疫联合治疗所带来的经济学影响。这也促使研究者们需要筛选出真正能从免疫治疗中受益的群体,从而真正改善肿瘤患者的预后。
既往研究发现在PD-L1高表达的GEAC患者中,纳武利尤单抗联合化疗相比于单独化疗而言,确实可改善患者的生存期[2]。那么对于PD-L1低表达的GEAC患者,ICIs的治疗效果究竟如何呢?
这个问题很快迎来了答案。
近日,来自新加坡国立大学癌症研究所的Raghav Sundar教授团队,在《临床肿瘤学杂志》发文,他们通过对3个GEAC临床队列进行回顾性分析,发现在PD-L1低表达的患者中,行化疗+PD-L1抑制剂与单纯化疗相比,患者总生存期(OS)及无进展生存期(PFS)均无明显差异(P=0.678)。
这一结果表明,在PD-L1低表达的GEAC患者中,化疗基础上联用ICIs并未使患者有明显的临床获益。
Sundar教授团队通过在EMBASE,Scopus,PubMed,Web of Science及ASCO 等数据库,对关于进展期GEAC患者行免疫治疗的III期临床研究进行检索,并对结果进行逐步筛选筛选,仅纳入同时包括患者KM曲线及PD-L1综合阳性评分(CPS)的临床研究队列。
最终只有三个临床队列符合要求:CheckMate-649[2],KEYNOTE-062[4],及KEYNOTE-590[5]。其中KEYNOTE-590队列中有一小部分患者(19/749人,2.54%)缺乏PD-L1 CPS评分,不过相对整体而言可以忽略不计。
接下来,研究者们选择CheckMate-649队列中PD-L1 CPS<1 及 CPS<5的患者亚组,对其OS及PFS的KM曲线采用KMSubtraction算法[6]进行重新分析;此外,他们也对KEYNOTE-590队列中PD-L1 CPS<10的食管癌患者组、KEYNOTE-062队列中PD-L1 CPS 1-9分的胃癌患者组进行分析,结果发现在各亚组患者中,ICIs+化疗组相比于单独化疗组并未改善患者的OS及PFS(图2)。
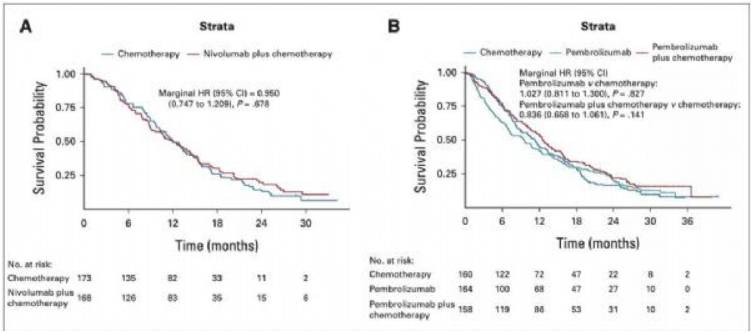
具体而言,在CheckMate-649队列的PD-L1 CPS 1-4分的亚组患者中,纳武利尤单抗联合化疗组与单纯化疗组患者的OS无明显差异(HR=0.950,P=0.678;图3A);与之类似,在KEYNOTE-062队列CPS 1-9分的亚组患者中,与单纯化疗组相比,帕博利珠单抗组(HR=1.027,P=0.827)及帕博利珠单抗联合化疗组(HR=0.836,P=0.141)对患者OS的改善也不显着(图3B)。
同样地,在CheckMate-649(图4A)及KEYNOTE-062(图4B)队列的PD-L1低表达亚组中,免疫治疗的加入也未能延长患者化疗后的PFS。此外,他们还发现帕博利珠单药组与化疗组相比,患者的PFS反而显着缩短(HR=2.092, P<0.01)。
总的来说,对于PD-L1低表达或不表达的GEAC患者,免疫治疗联合化疗与单纯化疗的效果相当,并未给患者的预后带来更多获益;而免疫治疗单药治疗组与单纯化疗相比,患者的肿瘤进展情况更为显着。
由此,研究者认为PD-L1的表达情况可作为评估ICIs疗效的生物学标记物,而检测PD-L1的表达对治疗方案的制定也将带来重要意义。
在PD-L1低表达的GEAC患者中应避免联用ICIs,以减少免疫治疗的毒副作用及经济负担;而在PD-L1高表达的患者中,也可通过动态监测PD-L1来评估ICIs对肿瘤治疗的效果。这个研究也为进展期GEAC患者的一线治疗方案的评估及选择提供了理论基础。








